Ablation ندول تیروئید
Ablation ندول تیروئید
در این مقاله تمرکز اصلی بر دو تکنیک پیشرفته ابلیشن حرارتی، یعنی ابلیشن با فرکانس رادیویی (RFA) و ابلیشن با مایکروویو (MWA) است. با توجه به افزایش شیوع ندولهای تیروئید و تمایل فزاینده بیماران به حفظ عملکرد طبیعی غده و اجتناب از جراحی، این روشها به عنوان جایگزینهای مؤثر و ایمن مطرح شدهاند. در این متن، جنبههای پاتوفیزیولوژیک، طبقهبندی کاندیداها، پروتکلهای دقیق انجام پروسیجر، نتایج بالینی، مدیریت عوارض و مقایسه جامع این رویکردها با تیروئیدکتومی سنتی مورد بحث قرار میگیرد.
پاتوفیزیولوژی و نیاز به درمان در ندولهای تیروئید
** اپیدمیولوژی ندولهای تیروئید
ندولهای تیروئید از شایعترین تودههای غدد درونریز هستند. شیوع آنها در جمعیت عمومی با افزایش سن، به خصوص در زنان، رو به افزایش است. مطالعات سونوگرافی نشان میدهند که بیش از ۶۷٪ از جمعیت بالغ ممکن است دارای ندولهای قابل تشخیص باشند، اگرچه تنها حدود ۵ تا ۱۰ درصد آنها بدخیم هستند.
** ماهیت ندولهای خوشخیم و دلایل مداخله
بخش اعظم ندولهای شناسایی شده (بیش از ۹۵٪) خوشخیم هستند و شامل آدنوماهای فولیکولار، کیستهای کلوئیدی، یا گواتر چندگرهای (Multinodular Goiter - MNG) میباشند. با این وجود، این ندولها میتوانند با ایجاد علائم بالینی، نیاز به درمان پیدا کنند:
- علائم فشاری (Compressive Symptoms): بزرگ شدن ندول و ایجاد حس توده در گردن، دیسفاژی (مشکل در بلع)، دیسفونی (تغییر صدا) یا تنگی نفس، به ویژه در مواردی که ندولها به سمت مدیاستن تحتانی گسترش یافتهاند (Retrosternal Extension).
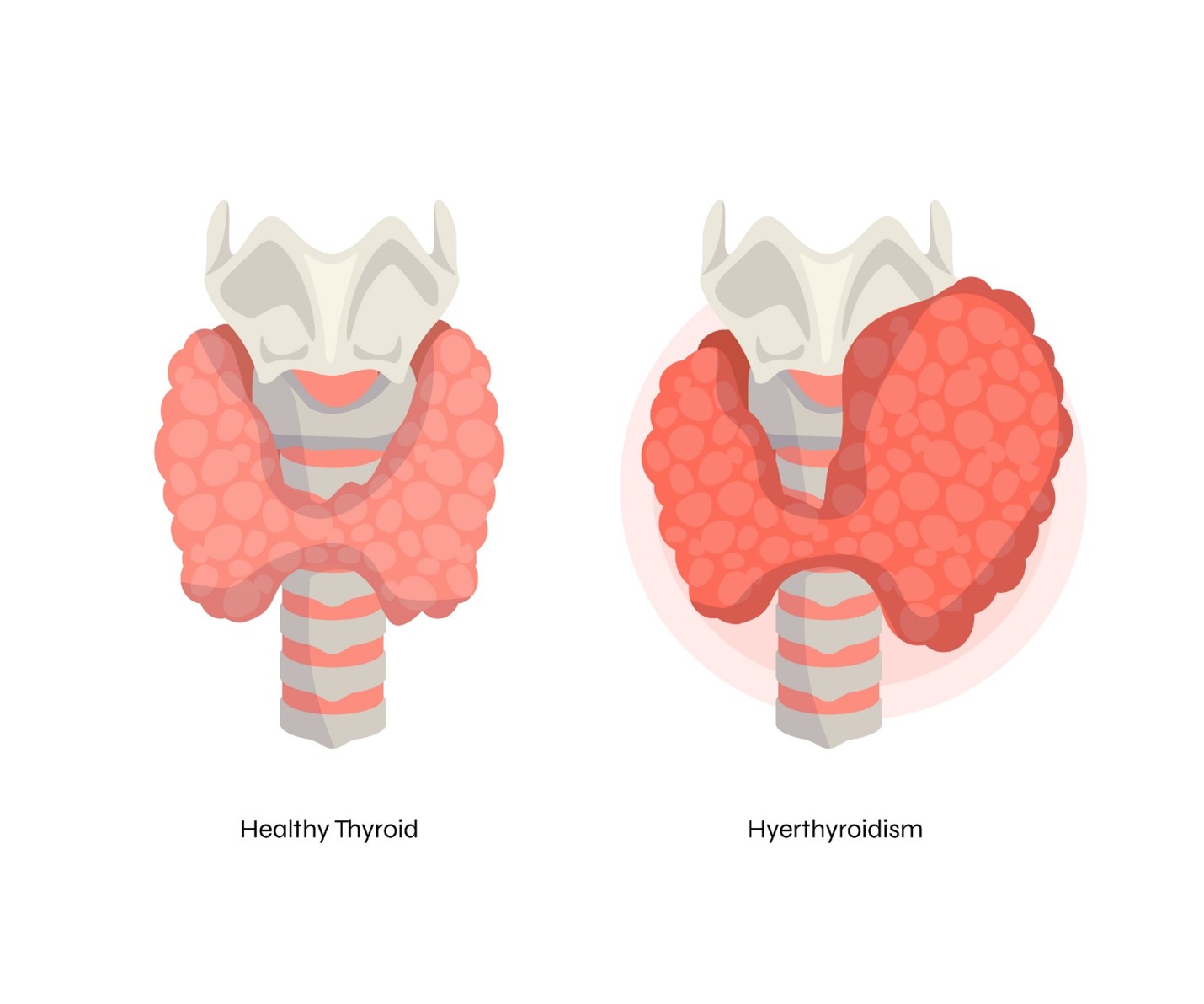
- اختلال عملکردی (Toxic Nodules): ندولهای گرم (Hot Nodules) که به صورت مستقل هورمون تیروئید بیش از حد ترشح میکنند و منجر به پرکاری تیروئید (Hyperthyroidism) میشوند، به خصوص در بیمارانی که کاندیدای مناسبی برای ید رادیواکتیو (RAI) یا جراحی نیستند.
- دلایل زیبایی و روانی: نگرانی بیمار از بزرگ بودن توده.
** گذار به درمان های کمتهاجمی
روش های سنتی درمان شامل جراحی (تیروئیدکتومی) و درمان با ید رادیواکتیو هستند. در حالی که جراحی استاندارد طلایی برای ندولهای بدخیم و گواترهای بزرگ است، محدودیتهایی در مدیریت ندولهای خوشخیم دارد:
- جراحی: نیاز به بیهوشی عمومی، بستری در بیمارستان، خطر آسیب به ساختارهای عصبی-عروقی (مانند عصب راجعه حنجره - RLN)، و در صورت تیروئیدکتومی کامل، وابستگی مادامالعمر به هورموندرمانی جایگزین.
- RAI: عموماً در ندولهای سمی مؤثر است اما در ندولهای غیرفعال (Cold Nodules) کارایی ندارد و ممکن است نیاز به دوزهای مکرر داشته باشد.
ابلیشنهای حرارتی، به ویژه RFA و MWA، به عنوان روشهای "برداشتن هدفمند نکروز" (Targeted Necrosis Ablation) مطرح شدهاند که امکان حفظ بافت سالم تیروئید، انجام به صورت سرپایی و با کمترین تهاجم را فراهم میآورند.
طبقه بندی و اندیکاسیونهای دقیق انتخاب بیمار
انتخاب صحیح بیمار برای ابلیشن حیاتی است. این انتخاب بر اساس ویژگیهای سونوگرافیک، سایز ندول، و علائم بالینی صورت میگیرد.
** سیستمهای امتیازدهی و ارزیابی اولیه
پیش از اقدام به ابلیشن، ارزیابی کامل شامل سونوگرافی، بیوپسی (FNA - Fine Needle Aspiration) و در صورت لزوم، آزمایشهای هورمونی الزامی است تا از خوشخیمی و مناسب بودن ندول اطمینان حاصل شود.
سیستمهای رادیولوژیک مانند TI-RADS (Thyroid Imaging Reporting and Data System) برای ارزیابی ریسک بدخیمی ندولها استفاده میشوند. برای ابلیشن حرارتی، معمولاً ندولهایی با ریسک پایین تا متوسط خوشخیمی (TI-RADS ۲ تا ۴) که علائم ایجاد کردهاند، کاندید هستند.
** اندیکاسیونهای اصلی برای ابلیشن حرارتی
ابلیشن های RFA و MWA عمدتاً برای درمان ندولهای خوشخیم با اندیکاسیونهای زیر به کار میروند:
- ندول های علامتدار (Symptomatic Nodules): ندولهای خوشخیمی که علائم فشاری (دیسفاژی، دیسفونی، احساس توده) ایجاد کردهاند، با حجم اولیه بزرگ (معمولاً > ۲ سانتیمتر).
- آدنوم های سمی (Toxic/Autonomous Adenomas): ندولهای گرمی که باعث پرکاری تیروئید شدهاند و بیمار به دلایل پزشکی، عدم تحمل ید رادیواکتیو یا عدم تمایل به جراحی، کاندیدای مناسبی برای ابلیشن هستند. هدف در این موارد، کاهش اندازه ندول و به تبع آن، کاهش تولید هورمون است.
- ندولهای عود کننده: ندولهایی که پس از جراحی یا RAI مجدداً رشد کردهاند.
- بیماران با ریسک بالا برای جراحی: بیمارانی که به دلیل مشکلات قلبی، ریوی یا سن بالا، تحمل بیهوشی عمومی و ریسکهای جراحی را ندارند.
کنترااندیکاسیونها (موارد منع مصرف)
- بدخیمی اثبات شده یا سوء ظن قوی به بدخیمی (بر اساس FNA).
- ندولهای بسیار بزرگ که ابعاد آنها به طور کامل تحت هدایت سونوگرافی قابل دسترسی نباشد (معمولاً > ۴ سانتیمتر، اگرچه این معیار در حال تغییر است).
- وجود اختلال در عملکرد انعقادی که ریسک خونریزی را افزایش دهد.
- ندولهایی که بسیار نزدیک به ساختمانهای حیاتی قرار دارند و امکان محافظت کامل آنها وجود ندارد.
- وجود ندولهای بافت نرم (Soft Tissue) خارج از کپسول تیروئید.
تکنیک های ابلیشن: RFA در برابر MWA
هر دو روش RFA و MWA از طریق تولید حرارت در بافت هدف، باعث انعقاد (Coagulation) و نکروز بافت ندول میشوند.
** RFA (Radiofrequency Ablation - ابلیشن با فرکانس رادیویی)
RFA رایجترین و تثبیتشدهترین روش ابلیشن تیروئید است.
مکانیزم عمل
RFA با استفاده از یک الکترود سوزنی نازک (معمولاً ۱ تا ۲ میلیمتر قطر) کار میکند که انرژی فرکانس رادیویی (معمولاً بین ۳۵۰ تا ۵۰۰ کیلوهرتز) را تولید میکند. این انرژی باعث نوسان سریع مولکولهای آب در بافت اطراف الکترود میشود که منجر به تولید حرارت جنبشی (Kinetic Heat) در دمای بالا (حدود ۶۰ تا ۱۰۰ درجه سانتیگراد) میگردد.
پارامترهای فنی در RFA
- الکترود: معمولاً از الکترودهای سوزنی تکقطبی (Monopolar) استفاده میشود. الکترود از طریق پوست وارد ندول شده و معمولاً با یک پد خنثی بزرگ (Grounding Pad) در پشت بیمار مدار کامل میشود.
- توان خروجی (Power Output): توان معمولاً بین ۵۰ تا ۱۲۰ وات تنظیم میشود. انتخاب توان بستگی به حجم ندول و حساسیت بافت اطراف دارد.
- تکنیک اجرا (Moving Shot Technique): برای دستیابی به ناحیه نکروز بزرگتر و جلوگیری از انتقال حرارت به بافتهای مجاور، الکترود در حین تولید انرژی، به آرامی از مرکز ندول به سمت محیط و سپس در مراحل بعدی، به صورت چرخشی حرکت داده میشود. هدف، ایجاد یک ناحیه نکروز حرارتی (Thermal Ablation Zone) با حاشیه ایمن در اطراف است.
** MWA (Microwave Ablation - ابلیشن با مایکروویو)
MWA یک روش نسبتاً جدیدتر است که از انرژی مایکروویو (معمولاً در فرکانس ۹۱۵ مگاهرتز یا ۲۴۵۰ مگاهرتز) استفاده میکند.
مزایای بالقوه MWA نسبت به RFA
- توزیع حرارتی گستردهتر: انرژی مایکروویو کمتر تحت تأثیر مقاومت امپدانس بافت قرار میگیرد و پتانسیل ایجاد ناحیه نکروز بزرگتری را با استفاده از یک پروب دارد (اثر "Ablation Cone" بزرگتر). این امر ممکن است به کاهش تعداد شاتها و زمان کلی پروسیجر منجر شود.
- کاهش اثر خنککنندگی (Heat Sink Effect): در برخی مطالعات، گزارش شده است که MWA کمتر تحت تأثیر اثر خنککنندگی ناشی از جریان خون در نزدیکی نواحی عروقی قرار میگیرد.
- تولید حبابهای بخار (Vaporization): در دماهای بالاتر، MWA میتواند باعث تبخیر آب داخل سلولی شود که این پدیده میتواند به ایجاد یک حباب بخار در ناحیه هدف کمک کند و تخریب موثرتری را فراهم آورد.
ملاحظات فنی MWA
الکترودهای MWA معمولاً شکل و جنس متفاوتی نسبت به RFA دارند (اغلب به صورت کواکسیال). تنظیم توان معمولاً بالاتر است (مثلاً ۵۰ تا ۲۰۰ وات)، اما نقطه کانونی تخریب (Focal Point) در نوک پروب قرار دارد.
** مقایسه سر و ته (RFA vs. MWA)
در حال حاضر، RFA به دلیل سابقه طولانیتر و دادههای بالینی قویتر، روش استاندارد ابلیشن تیروئید محسوب میشود. با این حال، MWA پتانسیل بالایی برای درمان ندولهای بزرگتر یا سختتر دارد. نتایج اولیه نشان میدهند که نرخ کاهش حجم در هر دو روش قابل مقایسه است، اما MWA ممکن است در کاهش زمان پروسیجر مزیت داشته باشد.
پروتکل عملیاتی پیشرفته تحت هدایت سونوگرافی
موفقیت ابلیشن حرارتی به شدت وابسته به دقت هدایت سونوگرافی و مدیریت محافظتی بافتهای مجاور است.
آمادهسازی بیمار و تجهیزات
بیمار در حالت لترال دکوبیتوس (دراز به پهلو) یا سوپاین (به پشت) با گردن کمی اکستند شده (با استفاده از بالشتک زیر شانهها) قرار میگیرد. نظارت بر علائم حیاتی (ECG، فشار خون، اکسیژن اشباع) در طول پروسیجر ضروری است.
تجهیزات لازم شامل دستگاه سونوگرافی با فرکانس بالا (ترجیحاً ۷ تا ۱۵ مگاهرتز)، پروبهای مخصوص RFA یا MWA، و دستگاه تولید انرژی با کنترل فیدبک دما (در صورت استفاده از سنسورهای دما).
هدایت سونوگرافی و تعیین مسیر
پروسیجر کاملاً تحت هدایت سونوگرافی در زمان واقعی (Real-Time Guidance) انجام میشود.
- نقشهبرداری ندول: سونوگرافی دقیق برای تعیین دقیق اندازه، محل، کپسول ندول، و ارزیابی نزدیکی به ساختارهای حیاتی (عروق کاروتید، ورید ژوگولار داخلی، نای، مری و مهمتر از همه، عصب راجعه حنجره - RLN).
- ورود الکترود: الکترود از مسیر کمخطرترین ناحیه (معمولاً از طریق قسمت جانبی یا قدامی گردن) وارد میشود. هدف، رسیدن به دورترین نقطه ندول (Distal Tip) با حفظ فاصله ایمن از کپسول است.
تکنیک هیدرو-دیسکشن (Hydro-dissection) برای حفاظت از ساختارهای حیاتی
این تکنیک پیشرفته، محافظت کلیدی در برابر آسیبهای حرارتی ناخواسته به بافتهای مجاور است.
هنگامی که نوک الکترود به نزدیکی ساختمانهای حساس (به ویژه RLN در شیار تراکئومدی استینال یا عروق کاروتید در دیواره جانبی) میرسد، یک محلول استریل (معمولاً سالین نرمال یا محلول بیحس کننده مخلوط با اپینفرین) به صورت محیطی (Perilesional Injection) تزریق میشود.
حائل مایع نه تنها به عنوان یک مانع حرارتی عمل میکند (زیرا آب هدایت حرارتی بهتری نسبت به چربی دارد و انرژی حرارتی را به طور موضعی نگه میدارد)، بلکه به عنوان یک "سپر دفاعی" در برابر آسیب عصب عمل میکند. این تکنیک به ویژه برای محافظت از RLN در ندولهای لوب تحتانی ضروری است.
تکنیک حرارتی پیشرفته: Moving-Shot Technique (تکنیک شات متحرک)
برای دستیابی به بیشترین میزان نکروز و پوشش کل حجم ندول، تکنیکهای حرکت الکترود ضروری هستند:
- شات اولیه (مرکزی): الکترود در مرکز ندول قرار داده شده و برای چند ثانیه فعال میشود تا ناحیه حرارتی مرکزی شکل گیرد.
- حرکت شعاعی: الکترود به آرامی و به صورت شعاعی (Axial) در طول محور الکترود به سمت محیط ندول کشیده میشود، در حالی که انرژی فعال است. این کار باعث میشود ناحیه نکروز به صورت یک خط طولی ایجاد شود.
- تکرار و پوشش محیطی: این فرآیند در زوایای مختلف (مانند ساعت ۱۲، ۳، ۶ و ۹) تکرار میشود تا کل حجم ندول، به استثنای حاشیه ایمن ۲ تا ۵ میلیمتری از کپسول، تحت پوشش حرارتی قرار گیرد.
- پوشش دقیق کپسول: در پایان، انرژی در نزدیکی کپسول اعمال میشود تا اطمینان حاصل شود که تمام بافت ندول نکروز شده است.
توجه: فعالسازی انرژی باید به صورت متناوب (Pulse-by-Pulse) انجام شود تا امکان ارزیابی سونوگرافی لحظهای ناحیه نکروز (کاهش اکوژنیسیته یا ایجاد حباب) فراهم شود و از آسیب ناخواسته به ساختارهای مجاور جلوگیری شود.
نتایج بالینی و پیگیری پس از ابلیشن
نتایج ابلیشن بر اساس دو پارامتر اصلی ارزیابی میشوند: کاهش حجم و تأثیر بر عملکرد (در ندولهای سمی).
** نرخ کاهش حجم (Volume Reduction Rate - VRR)
کاهش حجم ندول هدف اصلی در درمان ندولهای خوشخیم علامتدار است.
- ۶ ماه پس از پروسیجر: VRR مورد انتظار معمولاً بین ۳۰٪ تا ۵۰٪ است.
- ۱۲ ماه پس از پروسیجر: VRR به طور متوسط به ۵۰٪ تا ۷۵٪ میرسد. پیشرفت تخریب و جذب بافت نکروز شده در فاز فیبروتیک پس از چند ماه ادامه مییابد.
- ۲۴ ماه و بیشتر: بسیاری از ندولها به کاهش حجمی بیش از ۸۰٪ دست مییابند.
لازم به ذکر است که حجم ندولهای بزرگتر یا ندولهایی که دارای اجزای کیستیک قابل توجهی هستند، ممکن است نرخ کاهش حجمی کندتری داشته باشند.
** پیگیری سونوگرافی و بالینی
- فاز حاد (۱ هفته): ارزیابی وجود هماتوم، تغییرات حاد التهابی و بررسی عملکرد بلع و صدا.
- پیگیریهای بلندمدت: ارزیابیهای سونوگرافی در فواصل ۳، ۶، ۱۲ ماه و سپس سالانه انجام میشوند تا VRR و هرگونه عود محلی ارزیابی شود.
- ارزیابی هورمونی (برای ندولهای سمی): در ندولهای سمی، انتظار میرود که سطح TSH سرم به تدریج بهبود یابد. کاهش جذب ید رادیواکتیو در اسکن تیروئید و نرمال شدن سطوح T4/T3 معمولاً طی ۶ تا ۱۲ ماه مشاهده میشود.
** مدیریت ندولهای کیستیک
ندولهای با جزء مایع زیاد (بیش از ۵۰٪) ممکن است دچار تغییر شکل یا احساس توده موقتی پس از پروسیجر شوند. در این موارد، ممکن است ابلیشن با تزریق همزمان اتانول (PEI - Percutaneous Ethanol Injection) ترکیب شود یا نیاز به آسپیراسیون مجدد مایع و ابلیشن در مراحل بعدی باشد.
عوارض جانبی و مدیریت آنها
ابلیشنهای حرارتی تحت هدایت سونوگرافی، به دلیل ماهیت کمتهاجمی و هدفمند بودن، عوارض جانبی جدی کمتری نسبت به جراحی دارند. با این حال، عوارضی وجود دارند که نیازمند آگاهی کامل تیم درمانی هستند.
** عوارض شایع و خفیف
- درد و ناراحتی موضعی: شایعترین عارضه است که معمولاً با داروهای مسکن غیر استروئیدی (NSAIDs) کنترل میشود.
- ادم موضعی و کبودی: ناشی از ورود سوزن و مداخله بافتی.
- دیسفاژی یا احساس سفتی گذرا: به دلیل التهاب موقت بافت اطراف.
** عوارض جدی: آسیب به عصب راجعه حنجره (RLN Injury)
آسیب حرارتی به RLN یکی از مهمترین و نگرانکنندهترین عوارض است.
- پاتوفیزیولوژی: انتقال حرارت از ناحیه ابلیشن به صورت مستقیم یا از طریق بافتهای مجاور به عصب RLN که معمولاً در قسمت خلفی-جانبی تیروئید، نزدیک به شیار تراکئومدی استینال قرار دارد.
شیوع: در مراکز با تجربه، نرخ آسیب پایدار و شدید RLN بسیار پایین است (کمتر از ۰.۵٪). - مدیریت:
- پیشگیری: استفاده از تکنیک هیدرو-دیسکشن (Hydro-dissection) در اطراف ساختارهای حیاتی به ویژه در لوب تحتانی و نزدیک به کپسول.
- تشخیص: در صورت گزارش دیسفونی حاد پس از پروسیجر، نیاز به ارزیابی فوری لارنگوسکوپی توسط متخصص گوش، حلق و بینی (ENT) برای تایید فلج تارهای صوتی وجود دارد.
- درمان: در موارد موقت، مدیریت حمایتی و استفاده از درمانهای صوتی انجام میشود. در موارد نادر و پایدار، ممکن است نیاز به مداخله جراحی (مانند تزریق پرکننده به تارهای صوتی) باشد.
** سایر عوارض نادر
- آسیب به عصب حنجره فوقانی (SLN): به ندرت، به ویژه هنگام ابلیشن قطب فوقانی لوب تیروئید رخ میدهد و میتواند منجر به اختلال در تغییر زیر و بمی صدا (Pitch) شود.
- فیستول یا آبسهی تیروئید: بسیار نادر و مرتبط با عفونت یا نکروز گسترده.
- تنگی نای یا مری: در صورت ابلیشن غیرکنترل شده و ایجاد نکروز وسیع در مجاورت این ساختارها.
مقایسه جامع ابلیشن (RFA/MWA) با جراحی (تیروئیدکتومی)
انتخاب روش درمانی باید یک تصمیم دو جانبه بین پزشک و بیمار باشد که بر اساس تعادل بین اثربخشی، ریسکها و ترجیحات بیمار صورت میگیرد.
مزایای کلیدی ابلیشن
- حفظ عملکرد غده: مزیت بزرگ RFA/MWA، حفظ توانایی غده تیروئید در تولید هورمون و جلوگیری از هیپوتیروئیدی ناشی از درمان است.
- دوره نقاهت سریع: بیماران معمولاً روز بعد به فعالیتهای عادی باز میگردند.
- کاهش نگرانی بیمار: اجتناب از اسکار جراحی و خطرات مربوط به بیهوشی عمومی.
محدودیتهای ابلیشن
- محدودیت حجم: درمان ندولهای بسیار بزرگ (> ۴ سانتیمتر) یا ندولهایی که به شدت کلسیفیه شدهاند، چالشبرانگیزتر است.
- اثر زیبایی: اگرچه تهاجم کم است، اما در برخی بیماران، فرآیند فیبروز و کوچک شدن ممکن است منجر به فرورفتگی موقت یا تغییرات بافتی در محل تزریق شود.
- نیاز به تکرار: در مقایسه با جراحی که یک مداخله قطعی است، ابلیشن ممکن است نیازمند تکرار (Follow-up Ablations) برای دستیابی به حداکثر کاهش حجم باشد.
جمع بندی و چشم انداز آینده
ابلیشنهای حرارتی با فرکانس رادیویی (RFA) و مایکروویو (MWA) پارادایم درمانی ندولهای تیروئید خوشخیم را متحول کردهاند. این روشها، به ویژه در بیمارانی که علائم فشاری خفیف تا متوسط دارند یا کاندیدای ضعیفی برای جراحی هستند، نتایج قابل اعتمادی در کاهش حجم و بهبود علائم ارائه میدهند.
با افزایش دقت هدایت سونوگرافی و توسعه تکنیکهای محافظتی مانند هیدرو-دیسکشن، ایمنی پروسیجرها به طور چشمگیری بهبود یافته است. تحقیقات آینده بر روی استانداردسازی پروتکلهای انرژی، ارزیابی اثرات بلندمدت بر مورفولوژی گردن و احتمال ترکیب این روشها با سایر درمانهای هدفمند (مانند درمانهای ایمونومدولاتور) متمرکز خواهد بود تا اطمینان حاصل شود که ابلیشن به عنوان یک استاندارد درمانی قطعی برای ندولهای خوشخیم تثبیت گردد.